Autor/a: Dr. Gabriel Bucurescu EMedicine, Instant Access to the Minds of Medicine
La uremia constituye la etapa final de la insuficiencia renal progresiva y la falla multiorgánica resultante: Se produce por la acumulación de metabolitos de las proteínas y aminoácidos y la falla concomitante de los procesos catabólicos, metabólicos y endocrinológicos renales. No se ha identificado un metabolito único como causa de la uremia. La encefalopatía urémica es una de las muchas manifestaciones de la insuficiencia renal (IR)
Fisiopatología
La causa exacta de la EU se desconoce. Son varias las sustancias orgánicas que se acumulan, incluyendo la urea, los compuestos de la guanidina, los ácidos úrico y hipúrico, varios aminoácidos, polipéptidos, poliaminas, fenoles y conjugados de fenoles, ácidos fenólico e indólico, acetoína, ácido glucurónico, carnitina, mioinositol, sulfatos, fosfatos y, "moléculas medianas." Los niveles de algunos compuestos de guanidina, incluyendo el ácido guanidinosuccínico, la metllguanidina, la guanidina y la creatinina, aumentan tanto en los pacientes urémicos no dializados como en los dializados.
En varias regiones del cerebro, los pacientes con falla renal terminal tienen niveles elevados de ácido guanidinosuccínico (>100 veces), metilguanidina (20 veces), guanidina (>100 veces) y creatinina (5 veces). También está comprometida la vía cinurénica, por la cual el triptofano se convierte en cinureninas neuroactivas. Otras anormalidades halladas en la EU son la acidosis, la hiponatremia, la hiperkalemia, la hipocalcemia, la hipermagnesemia, la sobrehidratación y la deshidratración.
Las fases iniciales de la EU se caracterizan por la presencia de niveles elevados de glicina, ácidos orgánicos (derivados de la fenilalanina) y triptofano libre, y niveles disminuidos de GABA en el líquido cefalorraquídeo. Se cree que el cerebro urémico utiliza menos ATP y produce menos ADP, AMP y lactato, coincidiendo con una disminución generalizada de la función metabólica.
La transketolasa, hallada principalmente en las neuronas mielinizadas, es una enzima dependiente de la tiamina, en la vía de la pentosa fosfato, que mantiene la vaina de mielina de los axones. Esta enzima es inhibida por el plasma, el líquido cefalorraquídeo, y las fracciones dializadas de bajo peso molecular (<500 Da). La actividad de la transketolasa de los eritrocitos es menor en los pacientes no dializados que en los dializados. El ácido guanidinosuccínico puede inhibir la transketolasa y la transmisión sináptica excitatoria en la región CA1 del hipocampo de la rata, lo cual puede contribuir con los síntomas cognitivos de la EU.
La EU involucra muchas hormonas cuyos niveles están elevados, como la parathormona, la insulina, la hormona de crecimiento, el glucagón, la tirotrofina, la prolactina, la hormona luteinizante y la gastrina.
Una combinación de factores, como la hipercalcemia y la disminución de los GABA y la actividad de la glicina conduce al balance alterado de los efectos excitatorios e inhibitorios que contribuyen con las alteraciones sistémicas asociadas con la EU.
La frecuencia de la EU es difícil de determinar y su prevalencia mundial se desconoce.
Sin tratamiento, la insuficiencia renal es fatal; la EU refleja el empeoramiento de la función renal, cuyos síntomas empeoran en la medida que la insuficiencia renal progresa. Sin tratamiento, la EU llega al coma y la muerte. Los pacientes requieren un tratamiento intensivo en unidades de terapia intensiva y diálisis para evitar las complicaciones y mantener la homeostasis.
Es más común en afroamericanos que en otras razas; 4:1 con relación a pacientes de raza blanca. La incidencia es igual en ambos sexos y todas las edades pueden estar afectadas aunque es mayor en mayores de 65 años.
Como resumen, puede decirse que:
-La EU es una consecuencia de la insuficiencia renal
-Los síntomas comienzan en forma insidiosa y suelen ser primero detectados por los familiares o
o cuidadores.
-En muchos casos, el deterioro del sistema nervioso brinda la primera indicación de alteración metabólica.
-Los síntomas progresan en forma lenta o rápida.
-Los cambios en el sensorio comprenden pérdida de la memoria, falta de concentración, depresión, alucinaciones, irritabilidad, fatiga, insomnio, psicosis, estupor, catatonía y coma.
-Los pacientes pueden presentar alteraciones del lenguaje, prurito, calambres musculares o inquietud de piernas.
En el examen físico, los signos son variables y dependen de la gravedad de la encefalopatía. El examen neurológico va desde la normalidad hasta el estado comatoso. En la literatura se hallan casos de síndrome de Wernicke asociado con EU; este síndrome ha sido observado también en pacientes con demencia durante la diálisis, y el síndrome de desequilibrio durante la diálisis.
Signos físicos:
Mioclonías, calambres o fasciculaciones (síndrome de calambres y convulsiones urémicas postulado por Adams y colaboradores)
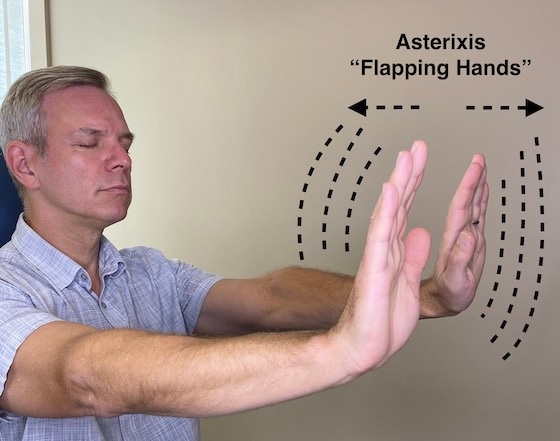
Asterixis
Disartria
Agitación
Tetania
Convulsiones, usualmente generalizadas, tónico-clónicas
Confusión, estupor y otras alteraciones del estado mental
Coma
La encefalopatía en diálisis (o demencia por diálisis) es una enfermedad subaguda, progresiva y fatal que se presenta en los pacientes sometidos durante largo tiempo a hemodiálisis. Se cree que es parte de una enfermedad multisistémica que incluye encefalopatía, osteomalacia, miopatía proximal y anemia.
La mitad de los pacientes puede presentar trastornos gastrointestinales inespecíficos atribuidos por algunos al aluminio del agua utilizada durante la diálisis. Los síntomas son disartria, apraxia, cambios en la personalidad, psicosis, mioclonías, convulsiones y demencia. En la mayoría de los casos, progresa hasta la muerte en 6 meses.
El síndrome de desequilibrio dialítico se presenta en pacientes en hemodiálisis. Los síntomas son cefaleas, náuseas, vómitos, visión borrosa, calambres musculares, desorientación, delirio, hipertensión, temblores y convulsiones. Tiende a ser autolimitada y dura varias horas. Se atribuye al efecto de la urea, la cual se depura del cerebro con mayor lentitud que en la sangre, causando un gradiente osmótico que provoca un flujo neto de agua al cerebro y edema cerebral transitorio.
Las complicaciones del trasplante renal pueden conducir a la EU. Se caracterizan por edema en la sustancia blanca. Los pacientes tienen riesgo de linfoma cerebral primario como así de infecciones oportunistas debido a la inmunosupresión prolongada.
La polineuropatía urémica es la complicación neurológica más frecuente de la insuficiencia renal
Causas de EU
La causa exacta de la EU se desconoce. Las etiologías posibles son la acumulación de metabolitos y, quizás, el desequilibrio en los neurotransmisores excitatorios e inhibitorios. También pueden ser factores contribuyentes la parathormona y el calcio anormales.
Estudios de laboratorio
-Ionograma y estudios de función renal anormales
-Los estudios de rutina del líquido cefalorraquídeo tienden a ser normales
-Estudios por imágenes
-Las imágenes cerebrales tienen escaso valor
La tomografía computarizada y los estudios de resonancia magnética muestran atrofia cerebral y dilatación ventricular secundaria. Ante la presencia de cambios agudos en el estado mental, estos estudios permiten excluir la hemorragia intracraneana y el hematoma subdural. La resonancia ha mejorado en forma paralela a la mejoría de la creatininemia y los niveles de nitrógeno ureico en sangre.
Otras pruebas
El EEG seriado permite monitorear la progresión de la enfermedad mostrando un enlentecimiento generalizado coincidiendo con la gravedad de la EU.
En la uremia aguda, se observa voltaje bajo irregular con enlentecimiento del ritmo alfa dominante posterior y explosión de ondas theta ocasionales. Las descargas espiculares bilaterales pueden estar asociadas con mioclonías, como también pueden verse convulsiones parciales.
Luego de comenzada la diálisis, el EEG puede empeorar durante 6 meses antes de que la función renal comience a normalizarse lentamente. La diálisis por sí misma no afecta el EEG.
En la uremia crónica, el EEG se estabiliza durante el tratamiento dialítico a largo plazo. Cuando las alteraciones aparecen durante los períodos de deterioro que coinciden con fluctuaciones de la urea sanguínea, se observa actividad delta y theta, espículas generalizadas y mayor sensibilidad a la fotoestimulación.
El EEG durante el sueño puede mostrar estallidos de alto voltaje (12-13 ondas/segundo), falta de huso en el estadio 2 del sueño y explosiones lentas de alto voltaje con el despertar.
Los potenciales evocados (visuales, autidivos, somatosensitivos) tienen escaso valor.
Procedimientos
Hemodiálisis
Diálisis peritoneal
Trasplante renal
Intervención neuroquirúrgica en caso de hemorragia intracraneana o hematoma subdural
Hallazgos histológicos
Fibrosis meníngea, cambios gliales, edema, degeneración vascular, degeneración neuronal focal y difusa y, desmielinización focal
También se pueden observar
-Infartos pequeños, probablemente por hipertensión o necrosis focal
-Necrosis celular granular aguda cerebelosa
Los pacientes con demencia durante la diálisis muestran alteraciones espongiformes en la parte externa de las capas corticales, con aumento de los niveles de aluminio sérico en la corteza cerebral. Otros cambios incluyen pérdida neuronal, acumulación del pigmento lipofucsina y degeneración neurofibrilar en la corteza motora y en los núcleos rojo, dentado y olivar.
Tratamiento médico
Corrección del trastorno metabólico, comúnmente mediante la diálisis (hemodiálisis o peritoneal) o el trasplante renal, con los cuales mejora la función renal.
Las convulsiones pueden ser tratadas con anticonvulsivantes, en dosis más bajas que las usuales
Tratamiento de urgencia del hematoma subdural o la hemorragia intracraneana
Adecuar las dosis de los medicamentos que el paciente recibe al grado de función renal
Tratamiento de la hipertensión y las infecciones
Tratamiento quirúrgico
La cirugía en la EU está limitada al trasplante renal, el hematoma subdural o la hemorragia intracraneana, además del acceso vascular.
Interconsultas con otras especialidades
Terapia intensiva
Nefrología
Cirugía vascular
Neurocirugía
Infectología
Dieta
Hiposódica, hipoproteica.
Actividad del paciente
En general, si el paciente está muy enfermo, requiere reposo en cama, por lo menos en la fase aguda.
Una vez que se comienza la hemodiálisis, debe ser un plan de sesiones regular, pudiendo ser necesario trasladar al paciente a un servicio especializado.
Complicaciones
La EU se complica con coma y muerte ante la falta de tratamiento
Pronóstico
Favorable, dependiendo de la eficacia del tratamiento. Es necesario asesorar al paciente, sus familiares y cuidadores para que soliciten atención médica inmediata ante cualquier cambio del estado mental.
Aspectos legales
Las siguientes situaciones pueden motivar el inicio de un juicio por mala praxis
-Caídas accidentales
-Comienzo de complicaciones no diagnosticadas por el lento comienzo de los síntomas
-Toxicidad farmacológica por monitoreo inadecuado
-Insuficiencia renal no diagnosticada
Traducción y resumen objetivo. Dra. Marta Papponetti. Especialista Medicina Interna. Doc. Aut. UBA. Editora responsable Intramed.