Autor/a: Shayna R. Cole, AuD, CCC-A and Julie A. Honaker, PhD, CCC-A Benign paroxysmal positional vertigo: Effective diagnosis and treatment
Resumen
El vértigo posicional paroxístico benigno (VPPB), causado por cristales rebeldes ("litos") en los canales semicirculares del oído interno, es la causa más común de síntomas breves de vértigo secundario a movimientos de la cabeza y el cuerpo. Diagnosticarlo y tratarlo es fácil de hacer en el consultorio médico.
Este artículo revisa el diagnóstico diferencial para pacientes que presentan mareos y vértigo, la fisiopatología del VPPB, cómo diagnosticarlo usando maniobras para provocar síntomas y nistagmo, cómo interpretar el patrón de nistagmo para determinar dónde están los litos y cómo tratarlo usando diferentes maniobras para reposicionar ("hacer rodar") las rocas de vuelta a donde pertenecen.
Puntos clave
|
Introducción
Los mareos son una queja común que puede afectar a personas de todas las edades: aproximadamente el 15 % de los adultos estadounidenses reportan problemas de equilibrio o mareos. Es el motivo de muchas visitas a la sala de emergencias, secundarias a condiciones benignas (p. ej., condiciones vestibulares, migraña, condiciones psicógenas) y condiciones graves (p. ej., accidente cerebrovascular, enfermedad inflamatoria del sistema nervioso central, tumor intracraneal o hemorragia).
Desafortunadamente, los trastornos del equilibrio a menudo son difíciles de diagnosticar y manejar, debido en parte a los síntomas subjetivos y la complejidad de las condiciones neurológicas, cardiovasculares, metabólicas, tóxicas, vestibulares y psiquiátricas que pueden causarlos. Los síntomas también pueden ser similares a los de las condiciones que amenazan la vida, lo que dificulta el diagnóstico.
Este artículo proporciona una actualización sobre el vértigo posicional paroxístico benigno (VPPB), un trastorno común del equilibrio, y cómo distinguirlo de otras causas de mareos, vértigo y desequilibrio con maniobras fáciles de cambio de posición. También discutimos la mejor manera de tratarlo con maniobras de cambio de posición.
Mareos vs vértigo
Los pacientes usan el término mareo para describir varias sensaciones diferentes, pero médicamente hablando es diferente del vértigo. El mareo es cualquier distorsión de la sensación de dónde uno está dentro de un espacio, mientras que el vértigo es una falsa sensación de movimiento, específicamente rotación o giro.
Una historia clínica completa puede diferenciar entre estas sensaciones y señalar una causa.
Las preguntas deben centrarse en lo siguiente:
- Calidad de los síntomas, como vértigo, oscilopsia (la ilusión de que los objetos se mueven de un lado a otro), desequilibrio general o aturdimiento.
- Evolución temporal de los síntomas, como la velocidad de inicio, la duración, las circunstancias del inicio, el tiempo transcurrido desde el episodio inicial y la frecuencia de los episodios.
- Factores asociados, como migraña o cambios en la visión, el oído o la respiración
- Factores que exacerban y alivian, como movimientos de la cabeza o del cuerpo, cerrar o abrir los ojos, mirar en una dirección u otra, entrar o salir de un campo visual ocupado, toser, estornudar o sonidos fuertes.
- Otros antecedentes médicos pertinentes, como problemas de visión, discapacidades de las extremidades inferiores, medicamentos que pueden causar mareos, diabetes, neuropatía, enfermedad cerebrovascular, accidente cerebrovascular, dolor de cuello, convulsiones, hipertensión, problemas cardíacos u ototoxicidad.
Los trastornos vestibulares comunes tienen características típicas que son clave para acotar rápidamente la causa de los síntomas y realizar las derivaciones adecuadas.
Una causa común de mareos y vértigo
El vértigo posicional paroxístico benigno (VPPB) es una de las causas vestibulares más comunes de mareos. Royl et al informaron que era el diagnóstico más frecuente en pacientes que acudían al servicio de urgencias con mareos. Su prevalencia aumenta con la edad y afecta con mayor frecuencia a personas mayores de 40 años. Es más común en mujeres que en hombres.
Aunque el VPPB es común, a menudo pasa desapercibido lo que lleva a procedimientos de diagnóstico, derivaciones y tratamientos costosos e innecesarios. Si no se detecta ni se trata, el VPPB también puede provocar una mala calidad de vida y caídas, la principal causa de lesiones y hospitalizaciones relacionadas con traumatismos en adultos mayores.
Episodios breves de vértigo asociados al movimiento
El vértigo posicional paroxístico benigno (VPPB) se presenta como breves episodios de vértigo, que suelen durar de segundos a minutos y se asocian con el movimiento de la cabeza, el movimiento del cuello o cambios de posición generales. Los desencadenantes comunes incluyen:
- Darse la vuelta en la cama.
- Mirar hacia arriba o hacia abajo.
- Levantarse desde una posición supina.
- Acostarse desde una posición sentada.
- Inclinándose hacia adelante.
Puede haber una latencia breve de segundos entre el cambio de posición inicial y los síntomas correspondientes. Los pacientes también pueden experimentar náuseas o emesis durante un episodio e informar una sensación general de flotación o desequilibrio.
Causas del vértigo posicional paroxístico benigno (VPPB)
En lo profundo de la parte petrosa del hueso temporal se encuentra el laberinto membranoso, alojado dentro del laberinto óseo (Figura 1). El laberinto membranoso está lleno de líquido (endolinfa) y alberga la cóclea y las estructuras vestibulares: los 3 canales semicirculares -anterior, posterior y horizontal (también llamado lateral) y los 2 órganos otolitos (sáculo y utrículo). Los canales semicirculares detectan la aceleración angular y los órganos otolitos detectan la aceleración lineal, proporcionando nuestras señales internas para la orientación de la posición en el espacio, el movimiento, la estabilización de la mirada y el control postural.
Figura 1
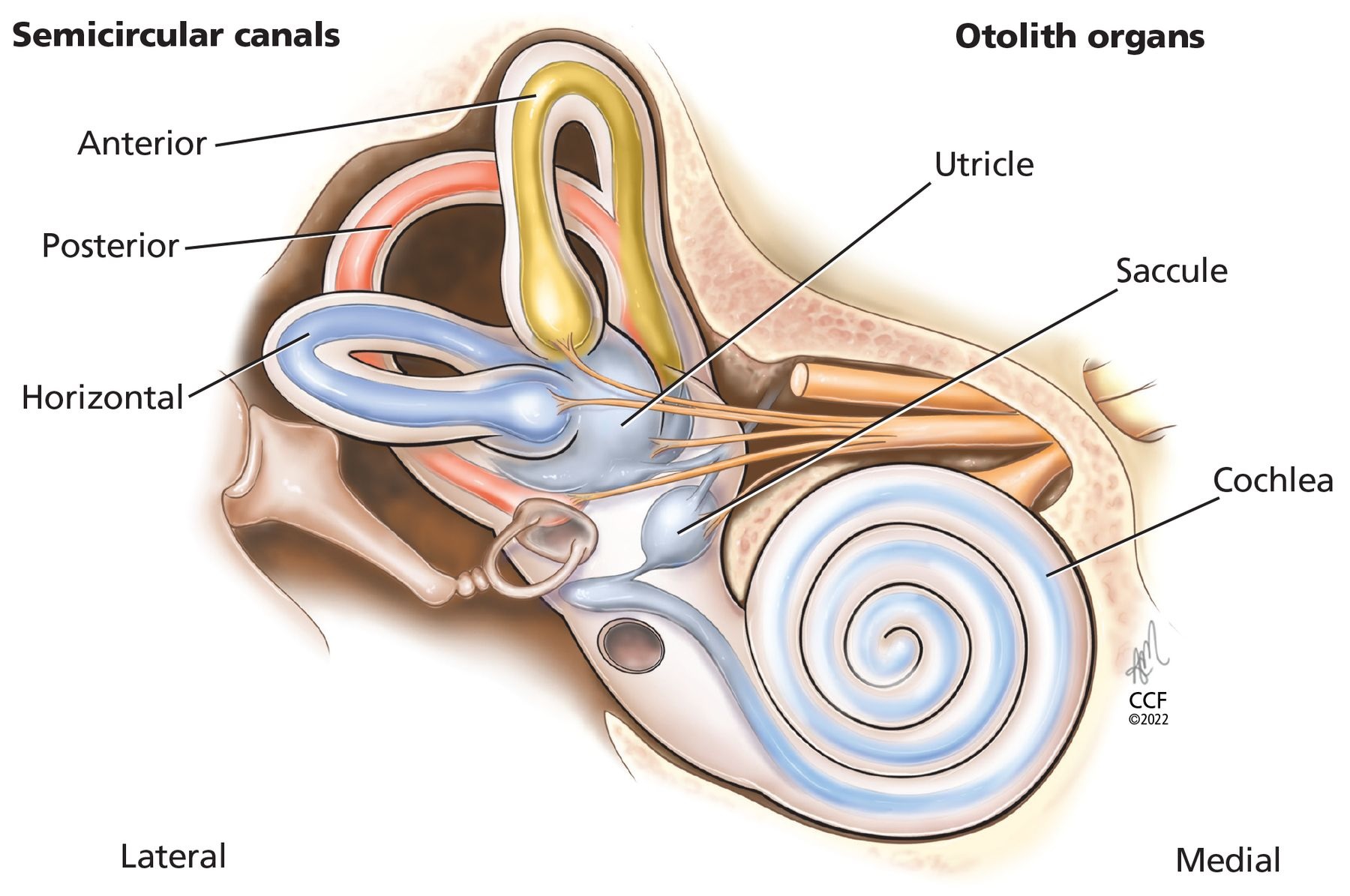
Los canales semicirculares (anterior, posterior, horizontal) detectan la aceleración angular y los órganos otolitos (sáculo, utícula) detectan la aceleración lineal, proporcionando señales internas para la orientación de la posición en el espacio, el movimiento, la estabilización de la mirada y el control postural.
Los movimientos corporales hacen que el líquido de los canales semicirculares se mueva y estimule los cilios de las células ciliadas sensoriales. Esto desencadena la transmisión de señales neuronales al cerebro para iniciar respuestas reflejas apropiadas para los ojos, la cabeza y los ajustes posturales. Estos movimientos reflejos nos permiten ver las cosas con claridad cuando nuestra cabeza y nuestro cuerpo están en movimiento y evitan que nos caigamos.
Los 3 canales semicirculares están colocados en ángulos de 90 grados entre sí y, por lo tanto, pueden detectar la rotación en todas las direcciones. Así, por ejemplo, al girar la cabeza para mirar por encima del hombro derecho, se excita el canal semicircular horizontal derecho y se inhibe el horizontal izquierdo.
El utrículo y el sáculo son sensibles a la gravedad y contienen cristales densos llamados otoconias que descansan sobre los órganos sensoriales. Con movimientos lineales (p. ej., inclinarse hacia un lado), las otoconias se mueven y señalan respuestas reflejas similares a las de los canales semicirculares para mantener el equilibrio de los ojos, la cabeza y el cuerpo.
El VPPB es causado por otoconias flotantes que se han desprendido de los órganos otolitos como resultado de una lesión, infección, diabetes, migraña, osteoporosis, reposo prolongado en cama o envejecimiento. Las otoconias desprendidas pueden acumularse en los canales semicirculares. Dado que cada canal semicircular está orientado en un plano diferente en el espacio, cuando las otoconias desprendidas se acumulan en uno o más de ellos, pueden estimularse al cambiar de posición y causar vértigo y nistagmo.
La mayoría de los casos de VPPB son idiopáticos o causados por un traumatismo craneal, pero pueden ser el resultado de otros trastornos vestibulares (p. ej., enfermedad de Menière, laberintitis) o trastornos del sistema nervioso central (p. ej., migraña, esclerosis múltiple).
La evidencia reciente sugiere que el VPPB tiene un aspecto estacional, quizás relacionado con niveles variables de vitamina D a lo largo del año. Las otoconias están compuestas de carbonato de calcio y, por lo tanto, podrían tener factores de riesgo de desmineralización, similares a los huesos. Maia et al 12 analizaron 214 pacientes diagnosticados con VPPB idiopático en Brasil durante 5 años y encontraron que significativamente más pacientes se presentaban en otoño e invierno que en primavera y verano. Esto sugiere que los niveles más bajos de vitamina D, debido a la menor cantidad de luz solar, podrían estar contribuyendo a la estacionalidad del VPPB.
Maniobras de diagnóstico
El vértigo posicional paroxístico benigno (VPPB) es relativamente simple de diagnosticar y tratar. Al mover al paciente en diferentes posiciones, observar sus movimientos oculares y preguntarle si siente que la cabeza le da vueltas, los médicos pueden determinar qué canal semicircular se está estimulando. La otoconia en el canal semicircular posterior representa hasta el 90% de los casos, y la otoconia en el canal horizontal representa la mayor parte del resto, mientras que la afectación del canal semicircular anterior es relativamente rara y generalmente se debe a maniobras de reposicionamiento fallidas para eliminar la otoconia del canal posterior.
El nistagmo consiste en la oscilación de los ojos y puede ser horizontal (hacia un lado y hacia atrás), torsional (de naturaleza rotatoria) o vertical (hacia arriba o hacia abajo y hacia atrás), o una combinación de algunas o las tres. La dirección y características de los movimientos oculares corresponden al canal semicircular estimulado durante el posicionamiento. Los síntomas son breves, a menudo duran menos de 60 segundos.
Maniobra de Dix-Hallpike
Las variantes del vértigo posicional paroxístico benigno (VPPB) que afectan a los conductos semicirculares verticales (es decir, el anterior y el posterior) se diagnostican mediante la maniobra de Dix-Hallpike. Consiste en 2 cambios de posición (sentado a supino y supino a sentado) con la cabeza del paciente girada 45° (Figura 2). Cuando se mueve al paciente de la posición sentada a la posición supina, el médico puede observar el patrón de movimiento ocular excitatorio del canal con la otoconia, con nistagmo horizontal hacia el oído afectado y cualquiera de los siguientes:
- Arriba (si las otoconias están en el canal posterior).
- Hacia abajo (si están en el canal anterior).
Figura 2
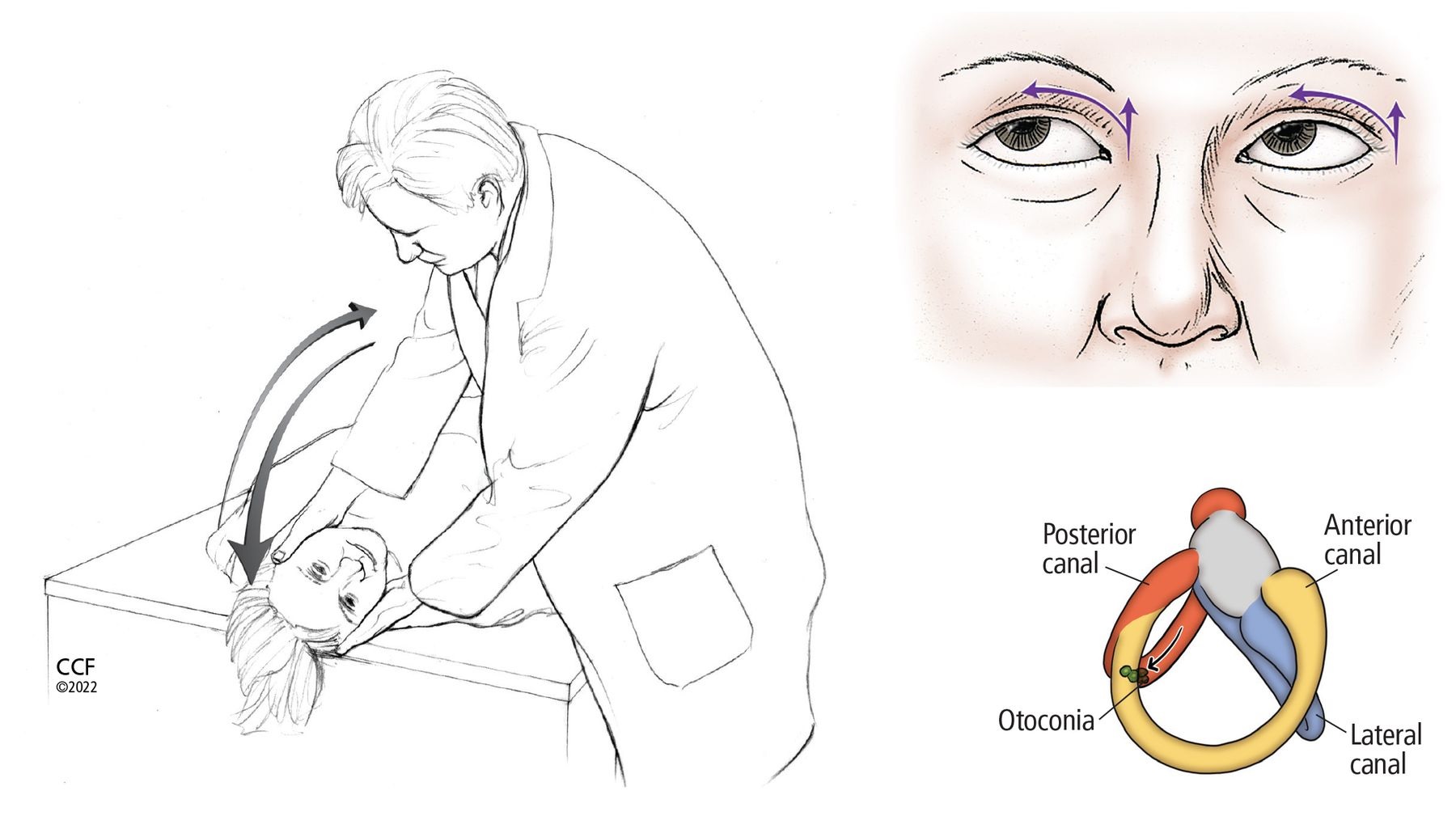
La maniobra de Dix-Hallpike para detectar otoconias en los canales semicirculares posterior o anterior. Si se sospecha que la otoconia está en el oído derecho, el paciente se sienta erguido con la cabeza girada 45° a la derecha; si se sospecha que la otoconia está en el oído izquierdo, el paciente gira la cabeza hacia la izquierda. Luego, el médico mueve rápidamente al paciente a una posición supina con la cabeza colgando y verifica si hay signos de nistagmo, y el paciente informa cualquier síntoma (p. ej., mareos, vértigo). Después de 60 segundos, se vuelve a colocar al paciente en una posición sentada con la cabeza todavía girada y el médico observa de nuevo los síntomas y signos. Durante la maniobra, el movimiento de la otoconia dentro del canal semicircular posterior derecho (en la imagen inferior derecha) provoca una respuesta excitatoria (es decir, nistagmo) hacia la derecha y hacia arriba, como indican las flechas en la imagen superior derecha.
Cuando el paciente pasa de la posición supina a la sedestación, debe observarse un patrón de nistagmo inverso, que indica la inhibición del canal con la otoconia, con nistagmo torsional hacia el lado sano y cualquiera de los siguientes:
- Abajo (para el canal posterior).
- Arriba (para el canal anterior).
Luego se repite la maniobra con la cabeza del paciente girada hacia el otro lado, es decir, para evaluar tanto el lado derecho como el izquierdo.
Prueba de giro supino
La maniobra de Dix-Hallpike no siempre provoca vértigo y nistagmo en los casos de VPPB que se deben a otoconias en el conducto semicircular horizontal. Por lo tanto, se recomienda la prueba de giro en decúbito supino como segunda maniobra de detección (Figura 3).
Figura 3

La prueba del giro supino para detectar otoconias en los canales semicirculares horizontales. (A) Con el paciente en posición supina, el médico gira rápidamente la cabeza del paciente hacia la derecha y evalúa el nistagmo horizontal y los síntomas del paciente. (B) Después de 30 a 60 segundos, el médico gira rápidamente la cabeza del paciente hacia la izquierda y nuevamente observa si hay nistagmo horizontal y síntomas. La dirección del nistagmo (es decir, geotrópico frente a apogeotrópico) con los cambios en el movimiento de la cabeza indica el canal horizontal afectado.
Un signo positivo de VPPB durante esta prueba es el nistagmo horizontal tanto en la posición de la cabeza a la derecha como a la izquierda. Si el nistagmo está en la misma dirección en la que gira la cabeza, el patrón se denomina geotrópico. Si es en la dirección opuesta, el patrón se llama apogeotrópico.
Consulte en caso de duda
Las guías de práctica clínica recientes indican que el diagnóstico adecuado de VPPB se realiza cuando se observan tanto los síntomas informados por el paciente como el patrón de nistagmo apropiado durante los cambios de posición. Sin embargo, pueden ocurrir resultados negativos falsos. Cuando se sospecha firmemente de VPPB en base a la historia, pero las maniobras de Dix-Hallpike y de giro en posición supina son negativas, se debe derivar al paciente a un terapeuta vestibular o a un audiólogo vestibular para una evaluación adicional.
Maniobras de tratamiento
Una vez diagnosticado el vértigo posicional paroxístico benigno (VPPB), el tratamiento se basa en el canal semicircular afectado. Esto implica una serie de movimientos de la cabeza y el cuerpo guiados por el médico para sacar la otoconia del canal semicircular y regresar al utrículo, con la ayuda de la gravedad. El proceso es simple y se puede realizar en una silla de examen estándar que se puede reclinar por completo o en una mesa. Estas maniobras a menudo pueden proporcionar un alivio inmediato y duradero. En varios estudios, su eficacia osciló entre aproximadamente el 76 % y el 93 %.
Maniobra de Epley para VPPB del canal posterior o anterior
En 1992, Epley describió una serie de movimientos de la cabeza y el cuerpo para sacar las otoconias de los canales semicirculares verticales (es decir, los posteriores y los anteriores). El procedimiento es fácil de realizar pero requiere atención cuidadosa para mantener la cabeza y el cuerpo del paciente en la posición adecuada durante toda la maniobra (Figura 4). Además, los ojos del paciente deben ser monitoreados a lo largo de cada etapa de la maniobra para observar el patrón de nistagmo, el cual debe permanecer consistente con el observado durante la maniobra de Dix-Hallpike o de giro en decúbito supino. Los patrones de nistagmo consistentes aseguran que el médico no haya movido la otoconia a un canal semicircular diferente en lugar de los órganos otolitos.
Figura 4

La maniobra de Epley para eliminar la otoconia de los canales semicirculares posterior o anterior:
- Coloque al paciente en posición sentada sobre la cama y gire la cabeza 45° hacia el oído con la otoconía sospechosa. Las inserciones de color muestran el movimiento de la otoconia.
- Mueva rápidamente al paciente a una posición supina con la cabeza girada y extendida hacia abajo.
- Mueva la cabeza del paciente hacia el otro lado, teniendo cuidado de mantenerla en el plano correcto. La posición final después del giro debe ser de 45° hacia el oído no afectado, extendido hacia abajo.
- Ayude al paciente a colocarse sobre el lado no afectado con la barbilla del paciente a 45° hacia la oreja no afectada (el paciente mirará hacia el suelo en esta posición).
- Finalmente, ayude al paciente a volver a sentarse, manteniendo la cabeza girada sobre el hombro.
Maniobra de Semont, una alternativa a la maniobra de Epley
La maniobra de Semont es una alternativa adecuada a la maniobra de Epley para tratar el VPPB del canal vertical. Esta maniobra requiere mover rápidamente al paciente a través de una serie de posiciones de la cabeza y el cuerpo (Figura 5).
Figura 5
 Maniobra de Semont, una forma alternativa de eliminar la otoconia de los canales posterior o anterior:
Maniobra de Semont, una forma alternativa de eliminar la otoconia de los canales posterior o anterior:
- Coloque al paciente en posición sentada sobre la cama y gire la cabeza 45° en dirección opuesta a la oreja con la otoconia sospechosa en el canal semicircular vertical.
- Mueva rápidamente al paciente de costado con la nariz hacia el techo.
- Mueva rápidamente al paciente hacia arriba y hacia el otro lado con la cabeza en el mismo ángulo de 45° con la nariz mirando hacia el suelo. Luego, el examinador ayuda al paciente a sentarse, manteniendo la cabeza a 45° del oído con sospecha de vértigo posicional paroxístico benigno del canal semicircular vertical (VPPB).
Nota: La posición de la cabeza descrita en el paso 1 se utiliza para el VPPB del canal semicircular posterior. El paciente debe girar la cabeza 45° hacia la oreja con sospecha de VPPB del canal semicircular vertical si el canal semicircular anterior está afectado.
Al igual que con la maniobra de Epley, el médico debe centrarse en los patrones de nistagmo a lo largo de la maniobra, que deben ser coherentes con los observados durante la exploración diagnóstica (p. ej., la maniobra de Dix-Hallpike).
La maniobra de giro para el tratamiento del VPPB del canal horizontal
Como se indicó anteriormente, el diagnóstico adecuado del VPPB del canal semicircular horizontal del lado afectado requiere una revisión cuidadosa del patrón de nistagmo (geotrópico frente a apogeotrópico) durante la prueba de giro en decúbito supino.
El VPPB de canal horizontal geotrópico es más común que el apogeotrópico. A menudo, escuchar al paciente describir sus síntomas y observar los patrones de nistagmo ayuda a determinar qué lado está afectado y debe tratarse. Se justifica la remisión a un especialista vestibular para garantizar el lado correcto y el tratamiento adecuado. Además, muchos otros trastornos pueden presentarse con nistagmo horizontal con cambio de dirección, y en estos casos se debe realizar una evaluación exhaustiva para confirmar o descartar el VPPB.
Dado que el VPPB del canal semicircular horizontal geotrópico es más común que la variante apogeotrópica, los médicos pueden realizar la maniobra de giro de 360°. Si la variante apogeotrópica está presente, se puede realizar la maniobra de Gufoni. Seguir los pasos que se muestran en la Figura 6 asegura la colocación adecuada de la cabeza y el cuerpo para sacar los desechos del canal horizontal afectado. Es imperativo apoyar la cabeza del paciente durante todos los movimientos. El paciente debe permanecer en cada posición hasta que desaparezcan los síntomas y el nistagmo.
Figura 6

Maniobra de giro (360°) para despejar otoconias del canal semicircular horizontal:
- Coloque al paciente en decúbito supino y gire la cabeza 90° hacia la oreja con la otoconia sospechosa en el canal semicircular horizontal.
- A continuación, gire la cabeza del paciente hacia el centro, con la cabeza elevada 30°.
- Maniobre al paciente de costado (90°) hacia el oído no afectado.
- Mueva al paciente a la posición prona con los codos flexionados. Nota: A veces, el tratamiento puede terminar en esta posición (llamada maniobra de 270°).
- Finalmente, ayude al paciente a ponerse de espaldas hacia el oído afectado, completando una rotación completa de 360°.
Ruta de atención del paciente con vértigo posicional paroxístico benigno (VPPB) La siguiente ruta de atención es una guía sugerida para evaluar y tratar el VPPB.
|