Autor: Kalia LV, Lang AE The Lancet. Volume 386, No. 9996
Resumen
- La enfermedad de Parkinson (EP) es una enfermedad neurológica compleja. Tiene las características motoras del parkinsonismo asociadas con los cuerpos de Lewy y la pérdida de neuronas dopaminérgicas en la sustancia negra. Actualmente se la reconoce como heterogénea, con características no motoras también importantes.
- Asimismo, su patología afecta a extensas zonas del sistema nervioso, diversos neurotransmisores y acúmulos proteicos además de los cuerpos de Lewy. La EP aparentemente se produce por el complejo interjuego de factores genéticos y ambientales que afectan a numerosos procesos celulares fundamentales.
- El diagnóstico es difícil en las primeras fases de la enfermedad al igual que el tratamiento de los síntomas en las fases avanzadas. No hay tratamientos que retrasen el proceso neurodegenerativo.
|
La enfermedad de Parkinson (EP) es una enfermedad neurológica frecuente y compleja. Es una afección neurodegenerativa con muerte precoz de las neuronas dopaminérgicas en la parte compacta de la sustancia negra (substantia nigra pars compacta; SNpc).
El resultado es la deficiencia de dopamina en los ganglios basales que genera un trastorno del movimiento caracterizado por los síntomas motores parkinsonianos clásicos. La EP también se asocia con numerosos síntomas no motores, algunos de los cuales aparecen más de una década antes de la disfunción motora.
No existen pruebas que permitan el diagnóstico definitivo en las primeras etapas de la enfermedad
El pilar del tratamiento de la EP es el tratamiento sintomático con fármacos que aumentan las concentraciones de dopamina o estimulan directamente los receptores de dopamina. La enfermedad afecta además a otros neurotransmisores y regiones del sistema nervioso fuera de los ganglios basales.
En la actualidad la EP se considera como un trastorno neurodegenerativo de progresión lenta que comienza años antes de que se pueda hacer el diagnóstico, implica múltiples zonas neuroanatómicas, se produce por una combinación de factores genéticos y ambientales y se manifiesta con una amplia gama de síntomas.
No existen pruebas que permitan el diagnóstico definitivo en las primeras etapas de la enfermedad. El criterio diagnóstico de referencia es la presencia de degeneración de la SNpc y la patología de Lewy en el examen posmortem.
Esta última consiste en acúmulos anormales de una proteína a-sinucleína, llamados cuerpos de Lewy y neuritas de Lewy. Las estrategias terapéuticas para muchas de las características discapacitantes que aparecen en las etapas tardías de la enfermedad son malas.
Estas características incluyen síntomas motores que no responden a los tratamientos dopaminérgicos o aparecen como complicaciones del empleo prolongado de fármacos dopaminérgicos, como así también un conjunto de síntomas no motores.
La mayor necesidad terapéutica no cubierta son tratamientos que disminuyan la velocidad de la neurodegeneración o detengan el proceso de la enfermedad. No obstante, los conocimientos sobre la patogénesis de la EP están aumentando y por lo tanto ayudando a identificar posibles blancos para modificar la enfermedad.
Los síntomas motores clásicos de la enfermedad fueron descritos por James Parkinson en el siglo XIX y más tarde perfeccionados por Jean-Martin Charcot. Estos síntomas son bradicinesia, rigidez muscular, temblor de reposo y alteración postural y de la marcha (cuadro 1).
Las características motoras en los pacientes con enfermedad de Parkinson son heterogéneas y aún no hay consenso en la clasificación de los subtipos de la enfermedad. Las observaciones clínicas sugieren dos subtipos principales:
- con predominio del temblor (y ausencia relativa de otros síntomas motores) y
- sin predominio motor (que incluye fenotipos descritos como síndrome acinético-rígido y trastorno de la marcha con inestabilidad postural).
Otro grupo de pacientes tiene un fenotipo mixto o indeterminado con varios síntomas motores de gravedad comparable.
Cuadro 1: Criterios diagnósticos del UK Parkinson’s Disease Society Brain Bank
Paso 1: Diagnóstico del síndrome parkinsoniano
- Bradicinesia (lentitud de inicio de los movimientos voluntarios con reducción progresiva de la velocidad y la amplitud de las acciones repetitivas) y al menos uno de los siguientes:
- Rigidez muscular
- Temblor de reposo de 4–6 Hz
- Inestabilidad postural no causada por disfunción visual primaria, vestibular, cerebelosa o propioceptiva
Paso 2: Criterios de exclusión de la EP como causa de parkinsonismo.
Uno o más de los siguientes sugieren otro diagnóstico
- Antecedentes de ACV repetidos con progresión lenta de las características parkinsoniana
- Antecedentes de traumatismos de cráneo repetidos
- Antecedentes de encefalitis confirmada
- Tratamiento con neurolépticos al comienzo de los síntomas
- Exposición a 1-metil-4-fenil-1,2,3,6-tetrahidropiridina (MPTP)
- Respuesta negativa a grandes dosis de levodopa (si la malabsorción es excluida)
- Más de un familiar afectado*
- Remisión sostenida
- Características estrictamente unilaterales después de 3 años
- Compromiso neurovegetativo grave temprano
- Demencia severa temprana con trastornos de la memoria, el lenguaje y la praxis
- Crisis oculogiras
- Parálisis supranuclear de la mirada
- Signo de Babinski
- Signos cerebelosos
- Presencia de un tumor cerebral o hidrocefalia comunicante en la tomografía computada
*Este criterio ya no se aplica .
Paso 3: Criterios positivos prospectivos que apoyan el diagnóstico de enfermedad de Parkinson
Se necesitan tres o más para el diagnóstico definitivo de EP
- Comienzo unilateral
- Temblor de reposo presente
- Enfermedad progresiva
- Asimetría persistente que afecta más el lado de comienzo
- Excelente respuesta (70–100%) a la levodopa
- Corea grave inducida por la levodopa
- Respuesta a la levodopa durante 5 años o más
- Curso clínico de 10 años o más
|
El curso y el pronóstico de la enfermedad difieren entre los subtipos; la enfermedad con predominio del temblor a menudo se asocia con menor velocidad de progresión y menos discapacidad funcional que la EP sin predominio del temblor.
Los trastornos del estado de ánimo y la constipación duplican el riesgo de sufrir EP
Las características no motoras son disfunción olfativa, deterioro cognitivo, síntomas psiquiátricos, trastornos del sueño, disfunción neurovegetativa dolor y fatiga. Estos síntomas son frecuentes al inicio de la enfermedad de Parkinson y se asocian con disminución de la calidad de vida relacionada con la salud. Las características no motoras con frecuencia están presentes antes del inicio de los clásicos síntomas motores.
Esta fase premotora o prodrómica de la enfermedad se puede caracterizar por alteración del olfato, constipación, depresión, somnolencia diurna excesiva y trastorno de conducta del sueño REM (movimientos rápidos de los ojos).
Se considera que los trastornos del estado de ánimo y la constipación duplican el riesgo de sufrir EP. La fase premotora puede ser prolongada, hasta de 12 - 14 años. Se supone que el proceso patológico que causa la EP está en marcha durante esta fase.
Es importante detectar esta etapa prodrómica ya que el tratamiento modificador, cuando esté disponible, podría prevenir o retardar la progresión de la enfermedad.
Al principio la enfermedad se puede controlar con tratamiento sintomático, pero a la medida que avanza, surgen complicaciones relacionadas con el tratamiento sintomático prolongado, entre ellas fluctuaciones motoras y no motoras, discinesia y psicosis que constituyen un desafío terapéutico.(Cuadro 2)
Cuadro 2: Complicaciones a largo plazo de los tratamientos dopaminérgicos para la EP
Fluctuaciones motoras
Alteraciones entre los períodos de buen control de los síntomas motores y períodos de poco control de estos síntomas
Fluctuaciones no motoras
Alteraciones entre los períodos de buen control de los síntomas no motores y los períodos de disminución del control de estos síntomas
Discinesia
Movimientos coreiformes o distónicos involuntarios, más frecuentes cuando las concentraciones de levodopa están en su máximo
Psicosis inducida por los fármacos
Las alucinaciones pueden ser fenómenos menores, como la sensación de que alguien está pasando por su campo visual periférico; también pueden ser alucinaciones visuales bien formadas y con menos frecuencia alucinaciones no visuales (auditivas, táctiles, olfativas; también puede haber delirios (a menudo con paranoia)
|
En las fases avanzadas de la EP se observa inestabilidad postural, rigidez de la marcha, caídas, disfagia y trastornos de la palabra. Los síntomas no motores son: incontinencia urinaria, constipación e hipotensión postural. Las probabilidades de demencia son del 83% si la enfermedad ha durado alrededor de 20 años. Cuando el paciente es resistente a la levodopa necesita internación en una institución especializada y su expectativa de vida es limitada.
La EP es la enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer. Su incidencia es de 10 - 18 por 100.000 años -persona. El género y la edad son factores de riesgo: es más frecuente en los hombres y aumenta exponencialmente con la edad llegando a su máximo después de los 80 años. Con el aumento de la expectativa de vida, se calcula que aumentará considerablemente en las décadas futuras.
Otros factores de riesgo son los ambientales:
- Exposición a pesticidas.
- Antecedentes de traumatismo de cráneo.
- Consumo de beta-bloqueantes.
- Actividad agraria y consumo de agua de pozo.
Los factores que reducen el riesgo son:
- Tabaquismo.
- Consumo de alcohol y de café.
- Antiinflamatorios no esteroides y bloqueantes de los canales del calcio.
Investigaciones mostraron que los pacientes con EP pueden dejar de fumar más fácilmente que los controles, lo que sugiere que la asociación negativa con el tabaquismo podría deberse a una menor respuesta a la nicotina durante la fase prodrómica de la EP.
Existe una tendencia hereditaria en la EP y se han detectado varios genes con mutaciones, la más importante es la mutación en GBA que codifica para beta-cerebrooxidasa, pero hay varios locus también implicados.
El riesgo de sufrir EP es multifactorial y recién se está descifrando el complicado interjuego entre los diversos factores.
La principal alteración anatomopatológica en la EP es la pérdida de neuronas dopaminérgicas en la SNpc. La pérdida de dichas neuronas en esta zona es probablemente la causa de los síntomas motores en los casos avanzados de EP.
Muchas otras regiones del cerebro presentan pérdida neuronal como el locus ceruleus, el núcleo basal de Meynert, el núcleo pedunculopontino, el rafe, el núcleo motor dorsal del vago, la amígdala y el hipotálamo. Otro signo patognomónico de la EP son los cuerpos de Lewy.
Braak et al, propusieron 6 etapas de cuerpos de Lewy, que se inician en el sistema nervioso periférico y van afectando en forma progresiva el sistema nervioso central. Existe relación entre el avance de los cuerpos de Lewy y la sintomatología. Las etapas 1 y 2 corresponderían al inicio de los síntomas premotores, la etapa 3 sería con la presencia de los síntomas motores debido a la deficiencia de dopamina nigroestriada y las etapas 4 a 6 coinciden con los síntomas no motores (alteraciones cognitivas) de la enfermedad.
Varios estudios post mortem mostraron una fuerte relación entre la demencia y la intensidad de patología por cuerpos de Lewy corticales. Estas formaciones serían las causales de la pérdida neuronal.
Sin embargo, en estudios más recientes se observó la presencia de otras moléculas como la alfa-sinucleína que forma una variedad de tipos de acúmulos. Uno de ellos serían ciertas formas oligoméricas de la alfa-sinucleína que podrían ser tóxicas para las neuronas.
También se detectaron otros acúmulos proteicos no relacionados con a-sinucleína, como placas beta-amiloide y ovillos neurofibrilares que contienen tau, las inclusiones proteicas características de la enfermedad de Alzheimer, con la misma cantidad y distribución que en esta.
Así, inclusiones de otras proteínas distintas a la a-sinucleína podrian actuar sinérgicamente con la patología de Lewy y contribuir a la expresión clínica dela EP.
Por último, con la identificación y caracterización de formas monogénicas de la EP, se halló que la enfermedad puede existir sin patología de Lewy. Esto sugiere que otras formas de acúmulos de a-sinucleína, así como inclusiones que contienen proteínas distintas a esta, son características anatomopatológicas importantes de la EP.
La neuroinflamación es otra característica anatomopatológica de la EP. Tanto la gliosis reactiva debida a los astrocitos activados como la microgliosis producida por activación de la microglía se hallan en las zonas de neurodegeneración.
Astrocitos y microglía participan en la eliminación de residuos extracelulares, lo que podría contribuir a la supervivencia de las neuronas. La microglía activada puede liberar factores tróficos, pero también especies reactivas del oxígeno y el nitrógeno y citosinas proinflamatorias. Aún no se ha determinado si el equilibrio entre estas acciones es favorable o perjudicial para las neuronas.
En los últimos 15 años se efectuaron importantes descubrimientos en la genética de la EP. El primer gen identificado relacionado con la EP fue SNCA y las mutaciones del mismo se asocian con el parkinsonismo autosómico dominante. Las mutaciones causantes de enfermedad incluyen las mutaciones de sentido erróneo, que producen sustituciones de los aminoácidos y multiplicaciones del locus del gen.
Las sustituciones de los aminoácidos debidas a estas mutaciones de sentido erróneo o al aumento de la expresión de las proteínas producido por las multiplicaciones del locus del gen hacen que la a-sinucleína sea proclive a formar acúmulos.
La EP relacionada con SNCA es rara, pero el reconocimiento de las mutaciones de SNCA como causa genética de la EP condujo a identificar a una a-sinucleína como el componente principal de los cuerpos de Lewy y las neuritas. Además, ese hallazgo dio lugar al descubrimiento de un listado creciente de genes asociados con las formas monogénicas de la EP
Se sugirió que seis genes participan en las formas autosómicas dominantes de la EP: SNCA, LRRK2, VPS35, EIF4G1, DNAJC13 y CHCHD2.
Parkin, PINK1 y DJ-1 se asocian con las formas autosómicas recesivas de la EP. A diferencia de la EP autosómica dominante, la EP autosómica recesiva se asocia más frecuentemente con inicio temprano (<40 años).
En la patogénesis de la EP parecen estar implicados los procesos celulares que participan en la regulación de la homeostasis proteica, entre ellos las alteraciones de la agregación proteica, la circulación de proteínas intracelulares y el tráfico transmembrana y la eliminación de las proteínas por los sistemas ubiquitina-proteasoma y de autofagia por lisosomas.
La genética de la EP también sugirió un papel para las aberraciones en la estructura y la función sináptica en la patogénesis de la EP y confirmó la importancia de la disfunción mitocondrial ya mostrada en modelos de EP causados por toxinas (por ej.6-hydroxy-dopamine (6-OHDA) and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP).
Los patólogos también produjeron hipótesis comprobables sobre la patogénesis de la EP. Por ejemplo, la estadificación de Braak, que propuso que el proceso patológico se extiende en forma estereotipada de una zona cerebral susceptible a la siguiente.
Braak y colegas postularon que este proceso comienza en la periferia, posiblemente accede al SNC a través de la vía nasal o gástrica y se extiende entre las neuronas a través de las sinapsis.
Datos de cuatro casos de pacientes con EP que recibieron trasplantes de células mesencefálicas embrionarias en el putamen mostraron que las inclusiones tipo cuerpos de Lewy se podían desarrollar dentro de las neuronas trasplantadas. Este dato incentiva la sugerencia de que en la diseminación de la patología de la EP participa la transmisión tipo prion de a-sinucleína entre las neuronas.
La neuroinflamación es una característica de la anatomía patológica de la EP, pero aún no se sabe si favorece la neurodegeneración o protege de ésta. Datos de metanálisis de estudios del genoma identificaron un solo polimorfismo nucleótido dentro de la zona de antígenos de los leucocitos que afecta el riesgo de contraer EP, lo que sugiere susceptibilidad genética a la EP relacionada con la inmunidad.
Además, los resultados de estudios epidemiológicos que mostraron menor riesgo de EP con el empleo de antinflamatorios, específicamente antinflamatorios no-esteroides apoyan la hipótesis de que la inflamación podría promover un proceso patológico subyacente.
El empleo de los bloqueantes de los canales de calcio y las altas concentraciones de urato en plasma también se asocian con disminución del riesgo de EP. Resultados de estudios anteriores sugirieron que las neuronas SNpc son especialmente proclives a mayor estrés oxidativo mitocondrial porque tienen altas cargas de calcio intracelular que causan aumento de la actividad mitocondrial.
Por eso los bloqueantes de los canales de calcio o el urato, un potente antioxidante, podrían proteger a las neuronas al disminuir las concentraciones de especies reactivas del oxígeno. La evidencia reunida apoya la participación de la inflamación y el estrés oxidativo en la patogénesis de la EP, aunque aún falta dilucidar los detalles mecanísticos.
Los marcadores más importantes son el deterioro olfatorio y la detección del trastorno de conducta del sueño
El diagnóstico de la EP se basa sobre la presencia de las características motoras del parkinsonismo: bradicinesia más rigidez y temblor de reposo.
No debe haber signos de alarma que sugieran otra causa de parkinsonismo, incluidas otras enfermedades neurodegenerativas, como la parálisis supranuclear progresiva, la atrofia multisistémica y la degeneración córticobasal. Los criterios del UK Parkinson’s Disease Society Brain Bank se emplean para el diagnóstico de EP (cuadro 1).
Estos criterios pueden alcanzar una sensibilidad de hasta el 90%. Aunque el criterio de referencia para el diagnóstico de EP es la evaluación neuropatológica, no hay criterios anatomopatológicos estándar aceptados generalmente.
El diagnóstico de EP depende de la presencia de pérdida neuronal de moderada a grave en la SNpc con cuerpos de Lewy en las neuronas SNpc supervivientes y ninguna evidencia patológica de otras enfermedades que puedan producir parkinsonismo. Otras entidades internacionales crearon un grupo de trabajo para definir criterios diagnósticos para la EP.
Se están investigando biomarcadores, especialmente para detectar tempranamente la EP antes del inicio de los síntomas motores. No existen fármacos que puedan retardar o detener la enfermedad, pero los fármacos modificadores de la misma pueden ser útiles en la etapa premotora.
Los marcadores más importantes son el deterioro olfatorio y la detección del trastorno de conducta del sueño REM mediante la polisomnografía.
Los candidatos a marcadores de estudios por imágenes son la tomografía por emisión de positrones (PET por las siglas del inglés) o la tomografía computarizada por emisión de fotón único (SPECT por las siglas del inglés) para medir la reducción en las terminales nerviosas dopaminérgicas de la SNpc que proyectan al núcleo estriado. Estas tecnologías pueden contribuir a diferenciar la EP con síntomas motores de los trastornos sin pérdida de neuronas SNpc (por ej, temblor esencial).
La capacidad de estos marcadores para efectuar esta diferenciación al inicio de la EP fue cuestionada tras los resultados de un estudio clínico que mostró una cantidad inesperada de pacientes con diagnóstico clínico de inicio de EP sin evidencia de deficiencia dopaminérgica.
El seguimiento longitudinal sugiere que la mayoría de estos pacientes probablemente no sufren EP. Es decir que PET o SPECT normales podrían descartar con exactitud el diagnóstico de EP y son anormales solo cuando hay pérdida considerable de neuronas dopaminérgicas en la SNpc y el objetivo es poder diagnosticar la enfermedad antes de que se produzca esta degeneración.
Otros marcadores se propusieron sobre la base del hallazgo de a-sinucleína en el sistema nervioso periférico, especialmente en el sistema nervioso entérico. Sin embargo, un estudio reciente proporcionó evidencia sólida de que la deposición colónica de a-sinucleína no es una prueba diagnóstica útil para la EP.
Se están estudiando otros marcadores en el líquido cefalorraquídeo, la saliva y la orina.
La a-sinucleína fosforilada en las fibras somáticas y autonómicas se identificó en biopsias de piel, pero hasta ahora en pacientes con EP ya diagnosticada.
Para personas con miembros de la familia con la forma monogénica de la EP las pruebas genéticas pueden ser útiles. Sin embargo, la mayoría de las causas monogénicas de la EP son incompletamente penetrantes, de modo que una prueba genética positiva en una persona asintomática no brinda un diagnóstico definitivo.
En lugar de un único estudio podría ser necesaria la combinación de biomarcadores de estudios por imágenes, estudios bioquímicos y genéticos para una enfermedad tan compleja.
> Neuroprotección y modificación de la enfermedad
La bradicinesia y la rigidez responden a los tratamientos dopaminérgicos desde el inicio de la enfermedad
Los tratamientos actuales solo actúan sobre los síntomas de la enfermedad. El principal objetivo es utilizar fármacos modificadores de la enfermedad que puedan enlentecer o detener su progreso. El problema radica en que las causas de la EP son heterogéneas y en la neurodegeneración participan procesos celulares múltiples.
Una estrategia más eficaz podría ser actuar sobre diversas vías disfuncionales y moleculares con varios fármacos. Los posibles blancos farmacológicos para modificar la EP son la neuroinflamación, la disfunción mitocondrial y el estrés oxidativo, la actividad de los canales de calcio, la actividad de la cinasa LRRK2, así como la acumulación y la transmisión de célula a célula de a-sinucleína (incluidas las técnicas de inmunoterapia).
Las posibles intervenciones quirúrgicas son la acción sobre los blancos genéticos, el trasplante de células y la estimulación cerebral profunda de los núcleos subtalámicos.
> Inicio del tratamiento sintomático
Los fármacos más importantes son los que aumentan las concentraciones intracerebrales de dopamina o estimulan sus receptores, entre ellas la levodopa, los agonistas de la dopamina, los inhibidores de la monoaminoxidasa tipo B y con menos frecuencia la amantadina.
El tratamiento se debería iniciar cuando los síntomas causan malestar o discapacidad y su objetivo es mejorar la calidad de vida.
La bradicinesia y la rigidez responden a los tratamientos dopaminérgicos desde el inicio de la enfermedad.
Los inhibidores de la monoaminooxidasa tipo B son solo moderadamente útiles. Los agonistas de la dopamina o la levodopa son necesarios para los síntomas más graves y la discapacidad progresiva. El temblor responde de forma errática al tratamiento de reemplazo de la dopamina. Los anticolinérgicos, como el trihexifenidilo o la clozapina pueden ser eficaces para el temblor.
Al decidir el tratamiento inicial de la EP se deben considerar las reacciones adversas inducidas por los fármacos. Los agonistas de la dopamina y la levodopa se asocian con náuseas, somnolencia diurna y edema y estos efectos suelen ser más frecuentes con la primera.
Los trastornos del control de los impulsos, como la ludopatía, la hipersexualidad, los atracones y los gastos compulsivos son mucho más frecuentes con los agonistas de la dopamina. Se los debe evitar en pacientes con antecedentes de estos problemas. Debido a que también se asocian más frecuentemente con alucinaciones no se los debe recetar a pacientes ancianos, en especial si sufren deterioro cognitivo.
La levodopa proporciona el mayor beneficio sintomático, pero su empleo prolongado se asocia con complicaciones motoras.
> Manejo de las complicaciones del tratamiento prolongado
Las complicaciones del tratamiento dopaminérgico prolongado son características de la enfermedad avanzada. Incluyen discinesia y fluctuaciones motoras y no. motoras y psicosis.
Se cree que las fluctuaciones y la discinesia se producen, en parte, por la estimulación pulsátil de los receptores de dopamina del núcleo estriado, que se producen recién cuando las concentraciones intracerebrales de levodopa se vinculan más estrechamente con las concentraciones plasmáticas de levodopa.
Para reducir estas fluctuaciones se agrega un agonista de la dopamina, el inhibidor de la monoamina oxidasa tipo B, o el inhibidor de la catecol-O-metiltransferasa.
Una nueva levodopa oral de liberación prolongada, IPX066, recientemente aprobada por la FDA, reduce las fluctuaciones.
Otro enfoque para lograr concentraciones plasmáticas constantes de levodopa es la administración de un gel concentrado, estable, de levodopa-carbidopa intraduodenal a través de una sonda de gastrostomía endogástrica percutánea unida a una bomba de infusión portátil.
Los resultados fueron buenos. La infusión subcutánea del potente agonista de la dopamina, apomorfina, también puede ser útil para las grandes fluctuaciones motoras. Los tratamientos no dopaminérgicos, como amantadina y clozapina, pueden ser útiles para las complicaciones motoras.
La psicosis en la EP se trata eficazmente con clozapina, pero se debe controlar regularmente el hemograma porque la clozapina se puede asociar con agranulocitosis potencialmente mortal. Con el control periódico del hemograma la agranulocitosis es infrecuente (riesgo 0.38%).
La quetiapina es menos eficaz, pero no es necesario el control hematológico. Otros neurolépticos se deben evitar porque con frecuencia agravan la EP.
> Tratamiento de los síntomas no motores
Las opciones terapéuticas para los síntomas no-motores de la EP son limitadas. No obstante existen varios tratamientos que son eficaces en algunos pacientes para mejorar la discapacidad causada por los síntomas no motores, tales como síntomas psiquiátricos, trastornos del sueño, disfunción neurovegetativa y cansancio.
La depresión asociada con la EP se trata con antidepresivos, siendo los más empleados los inhibidores selectivos de la recaptación de serotonina, como citalopram, escitalopram, fluoxetina, paroxetina y sertralina.
> Tratamiento de la fase avanzada de la EP
Los síntomas motores y no motores de la fase avanzada de la EP no responden bien a la levodopa. Alteraciones de los neurotransmisores no dopaminérgicos, entre ellos acetilcolina, glutamato, norepinefrina y serotonina, contribuyen a los síntomas de EP.
En especial, la disminución de la acetilcolina debido a degeneración de las estructuras colinérgicas podría asociarse con demencia, así como con disfunción de la marcha y caídas en la fase avanzada de la EP. Por lo tanto, el inhibidor de la colinesterasa rivastigmina es eficaz para tratar la demencia en la EP y se están estudiando sus efectos sobre la marcha, el equilibrio y las caídas.
> Tratamiento quirúrgico
Varios estudios mostraron que la estimulación cerebral profunda del núcleo subtalámico o el globus pallidus internus es eficaz para la EP de moderada a grave. La estimulación cerebral profunda talámica también es una opción para el tratamiento del temblor.
El tratamiento quirúrgico es una opción cuando los trastornos motores continúan respondiendo a la levodopa, pero las fluctuaciones motoras y la discinesia se tornan discapacitantes.
El tiempo promedio hasta la necesidad de tratamiento quirúrgico es de 10–13 años después del diagnóstico de EP.
Un estudio aleatorizado multicéntrico, (EARLYSTIM) señaló que la estimulación cerebral profunda del núcleo subtalámico tempranamente en el curso de la enfermedad (en promedio 7,5 años, con fluctuaciones motoras durante menos de 3 años) mejoraba la calidad de vida más que el mejor tratamiento médico. Los resultados de este estudio probablemente cambien la práctica actual de demorar las intervenciones quirúrgicas hasta más tarde en el curso de la enfermedad.
La enfermedad de Parkinson es compleja en su expresión clínica y tratamiento. Cabe esperar que mayores conocimientos sobre las vías moleculares y celulares que participan en el proceso neurodegenerativo produzcan biomarcadores útiles para el diagnóstico de la fase prodrómica inicial.
El resultado fundamental de las investigaciones en marcha sería la creación de tratamientos que modifiquen la enfermedad, que para ser eficaces deberían ser combinados y personalizados.
Resumen y comentario objetivo: Dr. Ricardo Ferreira
 Motivo de Internación : infección mano derecha.
Motivo de Internación : infección mano derecha.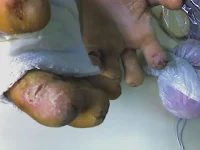 cial y profunda en dichas zonas. Estos procesos infecciosos han llevado a que perdiera en forma espontánea o quirúrgica todas las falanges de los dedos de ambas manos, y que presente asimismo mal perforante plantar en ambos pies, a nivel de las metatarsofalángicas de ambos dedos gordos
cial y profunda en dichas zonas. Estos procesos infecciosos han llevado a que perdiera en forma espontánea o quirúrgica todas las falanges de los dedos de ambas manos, y que presente asimismo mal perforante plantar en ambos pies, a nivel de las metatarsofalángicas de ambos dedos gordos spital Garraham se atribuyeron a su enfermedad de base.
spital Garraham se atribuyeron a su enfermedad de base.